








 Рейтинг: 4.5/5.0 (1901 проголосовавших)
Рейтинг: 4.5/5.0 (1901 проголосовавших)Категория: Бланки/Образцы
(ИРК / ИРФ) (Case Record Form / Case Study Form / Data Collection Form) Это бумажный, оптический или электронный документ, предназначенный для внесения в него информации по каждому испытуемому, предусмотренной протоколом клинического исследования.
Индивидуальные регистрационные карты служат выполнению нескольких задач:
• обеспечивают сбор данных в соответствии с Протоколом
• обеспечивают удовлетворение требований органов контрольно-разрешительной системы для сбора информации
• способствуют эффективной и полной обработке данных, их анализу и отчетности по результатам; способствуют обмену данными по безопасности среди проектной группы и других подразделений организации
Данные, собранные во время проведения испытания в исследовательском центре, должны быть полными и точно отражать, что произошло с каждым испытуемым. Только в случае соответствия этим критериям исследование достоверно отвечает на вопросы об эффективности и безопасности изучаемого лекарственного средства.
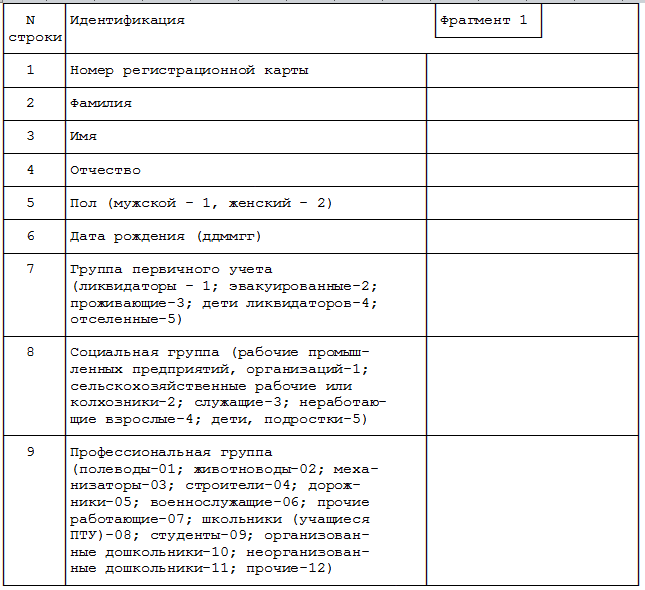
Во всех ИРК должны быть указаны следующие данные:
• номер, название исследования
• фамилия исследователя
• идентификационные данные испытуемого/пациента (номер и инициалы)
• информация о критериях включения/исключения
• демографические данные
• детальное описание дозирования исследуемого препарата
• сопутствующий курс лечения
• случаи неблагоприятных реакций (побочные эффекты и интеркуррентные заболевания)
• заключение о состоянии здоровья испытуемого
• подпись исследователя и дата
Кроме того, в ИРК должны быть предусмотрены страницы для внесения информации по следующим позициям:
• история болезни
• данные физического обследования
• основной и сопутствующий диагноз
• предыдущий релевантный курс лечения
• характеристика исходного состояния, промежуточные исследования и измерения конечных показателей эффективности, лабораторные тесты, процедуры и т.д.
ИРК должны быть разборчивыми и годными для копирования и возможного дополнительного распространения.
Индивидуальный подход в решении онкологических проблем
Костюк
Игорь Петрович
руководитель хирургической службы МРНЦ
Мои основные специализации: Основные разделы сайта:Права на сайт и контент принадлежат Костюку Игорю Петровичу
Мои странички в соцсетях:
Индивидульная регистрационная карта - это бумажный, оптический или электронный документ, предназначенный для внесения в него информации по каждому испытуемому, предусмотренной протоколом клинического исследования. Наша компания предлагает совершенно уникальную услугу для клиента в России и СНГ, а именно электронную систему индивидульных регистрационных карт (эИРК ) (Electronic CRF). Вы сможете собирать, вносить запись с информацией о состоянии пациента в базе данных и отслеживать каждого пациента через электронный доступ.
Индивидуальные регистрационные карты служат выполнению нескольких задач:
Данные, собранные во время проведения испытания в исследовательском центре, должны быть полными и точно отражать, что произошло с каждым испытуемым. Только в случае соответствия этим критериям исследование достоверно отвечает на вопросы об эффективности и безопасности изучаемого лекарственного средства.
Во всех ИРК должны быть указаны следующие данные:
• номер, название исследования
• фамилия исследователя
• идентификационные данные испытуемого/пациента (номер и инициалы)
• информация о критериях включения/исключения
• демографические данные
• детальное описание дозирования исследуемого препарата
• сопутствующий курс лечения
• случаи неблагоприятных реакций (побочные эффекты и интеркуррентные заболевания)
• заключение о состоянии здоровья испытуемого
• подпись исследователя и дата
Кроме того, в ИРК должны быть предусмотрены страницы для внесения информации по следующим позициям:
• история болезни
• данные физического обследования
• основной и сопутствующий диагноз
• предыдущий релевантный курс лечения
• характеристика исходного состояния, промежуточные исследования и измерения конечных показателей эффективности, лабораторные тесты, процедуры и т.д.
ИРК должны быть разборчивыми и годными для копирования и возможного дополнительного распространения.
«Индивидуальная регистрационная карта; ИРК (Case Report Form; CRF): Документ на бумажном, электронном или оптическом носителе, предназначенный для внесения всей предусмотренной протоколом и подлежащей передаче спонсору информации по каждому субъекту исследования.» (ГОСТР 52379-2005)*
Несмотря на то что бумажные индивидуальных регистрационная карты до сих пор активно используются, на смену им приходят современные решения сбора биостатистики, применяя электронные версии (эИРК / eCRF). эИРК это высокоэффективный инструмент проведения медицинских исследований, позволяющий использовать многочисленные достижения информационных технологий.
ЦЕЛИ РАЗДЕЛАИндивидуальная Регистрационная Карта (Case Report Form/CRF/ИРК) служит средством для сбора данных, определенных в Протоколе исследования. Все Индивидуальные Регистрационные Карты каждого исследования на каждого отдельного испытуемого собираются в Индивидуальный Регистрационный Журнал (Case Report Book/CRB/ИРЖ).
ЦЕЛИ ИРКИндивидуальная Регистрационная Карта (ИРК) представляет собой средство сбора данных исследования на бумажных носителях, проводимого в исследовательском центре. В некоторых исследованиях для этих целей используются также электронные средства. Мы будем использовать термин ИРК в общем смысле, который включает в себя все средства сбора данных исследования.
Индивидуальные Регистрационные Карты служат выполнению нескольких задач:
• Обеспечивают сбор данных в соответствии с Протоколом;
• Обеспечивают удовлетворение требований регулятивного органа для сбора информации;
• Способствуют эффективной и полной обработке данных, их анализу и отчетности по результатам; а также
• Способствовать обмену данными по безопасности среди различных Проектных Групп и подразделений организации.
Данные, собранные во время проведения испытания в исследовательском центре, должны быть полными и точно отражать, что произошло с каждым испытуемым. Только в случае соответствия этим критериям, исследование достоверно отвечает на вопросы об эффективности и безопасности изучаемого лекарственного средства.
НОРМАТИВЫ ПЛАНИРОВАНИЯ ИРКХотя в Протоколе определены конкретные данные, которые должны быть отражены в Индивидуальных Регистрационных Картах (ИРК), существуют также и другие нормативы, которые регулируют содержание ИРК. Например, нормативы проекта могут определять типы оценок или требования по сбору данных.
Во всех ИРК должны быть указаны данные по следующим позициям:
• Номер, название исследования;
• Фамилия исследователя;
• Идентификационные данные испытуемого/пациента (номер и инициалы);
• Информация о критериях включения/исключения;
• Демографические данные;
• Детальное описание дозирования исследуемого препарата;
• Сопутствующий курс лечения;
• Случаи побочного действия (побочные эффекты и интеркуррентные заболевания);
• Заключение о состоянии здоровья испытуемого, а также
• Подпись исследователя и дата.
Также в состав журналов Индивидуальных Регистрационных Карт должны быть включены модули для сбора конкретной информации по следующим позициям:
• История болезни;
• Данные физического обследования;
• Основной диагноз и сопутствующие диагнозы;
• Предыдущий релевантный курс лечения; а также
• Характеристика исходного состояния, промежуточные исследования и измерения конечных показателей эффективности, лабораторные тесты, процедуры и т.д.
Протокол определяет те данные, которые вносятся в Индивидуальные Регистрационные Карты (ИРК). Это означает, что все данные, которые указаны в Протоколе, подлежат сбору в Индивидуальных Регистрационных Картах (ИРК), а те данные, которые не будут подвергнуты анализу, не включают в ИРК.
ВНЕШНИЙ ВИД И УДОБСТВО В ИСПОЛЬЗОВАНИИВнешний вид Индивидуального Регистрационного Журнала (Case Report Book/CRB/ИРЖ) создает общее впечатление и представление о научно-исследовательской организации.
Поэтому Индивидуальный Регистрационный Журнал должен:
• Давать представление о высоком качестве исследования;
• Быть легким в использовании и заполнении;
• Обеспечивать исследователей четкими и простыми в выполнении инструкциями;
• Задавать четкие вопросы, предполагающие ясные недвусмысленные ответы;
• Иметь структуру, способствующую точному выполнению задач и записи результатов; а также
• Быть предельно сжатым.
Один Испытуемый, Один Индивидуальный Регистрационный Журнал У каждого изучаемого испытуемого есть свой Индивидуальный Регистрационный Журнал (ИРЖ), вне зависимости от того, рандомизирован ли этот испытуемый или заканчивает курс исследования. Хотя в фармакокинетических исследований используется один Индивидуальный Регистрационный Журнал для всех испытуемых. Индивидуальный Регистрационный Журнал представляет собой документ, в котором собрана вся релевантная информация, включая информацию об оформленном Информированном Согласии и о соответствии критериям приемлемости (критерии включения).
Блок-схема, разработанная в качестве приложения к Протоколу, обычно перепечатывается на обложке каждого Индивидуального Регистрационного Журнала. Данная блок-схема представляет собой руководство к действию по проведению оценок и назначений изучаемого лекарственного средства в правильной последовательности. В блок-схеме должны быть точно отражены события, указанные в Индивидуальном Регистрационном Журнале.
ОЦЕНКУ ЭФФЕКТИВНОСТИ В ОТНОШЕНИИ ЛЕКАРСТВЕННОГО ВЕЩЕСТВА ИЛИ КОНКРЕТНОГО ПОКАЗАНИЯ ПРОВОДЯТ ОДНОВРЕМЕННО С ОЦЕНКОЙ БЕЗОПАСНОСТИ.
В тех Индивидуальных Регистрационных Журналах, где используется карта ИРК "визит за визитом", страницы должны быть скомпонованы в таком порядке, в каком они будут заполняться в ходе исследования. Это значит, что за всеми страницами, которые должны быть заполнены во время первого визита, следуют страницы, которые должны быть заполнены во время второго визита; а после этих страниц следуют страницы, предназначенные для заполнения во время последующих визитов. При заполнении подобной "учетной" формы ИРК все данные одного типа, собранные в ходе исследования, записываются на одной странице.
Исследователь несет ответственность за все данные, записанные в Индивидуальные Регистрационные Карты, и должен заверять их своей подписью и датой. Критерии Разработки Когда Вы разрабатываете Индивидуальные Регистрационные Карты (ИРК), следует руководствоваться имеющимся у Вас Протоколом.
Индивидуальные Регистрационные Карты должны:
• Собирать данные по безопасности;
• Следовать стандартам проекта по сбору данных;
• Собирать информацию согласно требованиям Протокола;
• Применять четкую систему сбора данных;
• Минимизировать дублирование данных;
• Включать критерии включения, исключения, удовлетворяющие требованиям Протокола;
• Включать идентификационные и демографические данные об испытуемом, а также его диагноз.
Строгое соблюдение этих стандартов в оформлении ИРК обеспечивает повышению уровня качества сбора информации и простоту использования карт группой исследовательского центра, фармацевтической фирмой и регулятивными органами.
ПРОЦЕСС РАЗРАБОТКИ ИРКСодержание ИРК вытекает из содержания Протокола, следовательно, ИРК не могут разрабатываться без учета основных положений Протокола. Лучше всего начинать разработку ИРК после просмотра структурного проекта или скелета Протокола. Для этого есть две причины:
• Во-первых, при разработке ИРК могут возникнуть проблемы, решение которых связано с изменением Протокола, таким образом, разработка ИРК и рецензии Протокола должны проводиться одновременно.
• Во-вторых, Индивидуальный Регистрационный Журнал (ИРЖ) уже должен быть в наличии, когда исследовательские центры начинают набор испытуемых. Для того чтобы избежать задержек в инициации исследования, планирование ИРК должно быть начато во время разработки Протокола.
Черновой вариант Индивидуального Регистрационного Журнала (ИРЖ) анализируется группой проекта так же, как Протокол. Такой анализ носит междисциплинарный характер и является необходимым для того, чтобы Индивидуальные Регистрационные Карты (ИРК) представляли собой целостный документ, отвечающий регулятивным, статистическим и информационно-управляющим требованиям. Кроме того, в этих картах не должно быть расхождений с Протоколом. Протокол должен утверждаться до закрытия и подписания журнала. После утверждения журнал может быть отпечатан. Следует отпечатать несколько дополнительных экземпляров журнала с целью внесения коррекций о замене пациентов, клиническое исследование которых было прервано (обычно это еще 20% от числа пациентов, зарегистрированных в Протоколе). Если ожидается, что большое число испытуемых не пройдет процесс оценки по критериям включения и исключения, можно отпечатать комплект Индивидуальных Регистрационных Карт (ИРК) для тех, кто прошел отбор. Этот комплект прилагается к оформленному Индивидуальному Регистрационному Журналу только тогда, когда испытуемый соответствует критериям приемлемости и отобран в результате случайной выборки. Это позволит избежать ненужной траты журналов ИРК в тех случаях, когда число испытуемых, не прошедших оценку, слишком велико.
Четкое оформление Индивидуальной Регистрационной Карты Заполнение ИРК должно быть разборчивым и аккуратным. Следует избегать мелкого шрифта, несовпадения колонок и нагромождения вопросов.
Ячейки, предназначенные для букв и цифр предпочтительно делать с открытым верхом (|_|_|_|_|_|_|_|_|_|_|), так как закрытые часто являются причиной неясности при прочтении. Даже при проведении небольших клинических исследований, важно помнить, что печатные буквы предпочтительнее прописных.
Для облегчения исправлений, ввода данных в компьютер, кодирования и архивации данных, лучше пользоваться самокопирующимися бланками в трех экземплярах. Даже при хорошем почерке для заполнения необходима шариковая ручка с чернилами черного цвета. Желательно, чтобы бланки были разного цвета: первая копия служит в качестве оригинала, подписанного и хранящегося у заказчика/спонсора исследования. Заполненные бланки должны быть разборчивыми и годными для копирования и возможного дополнительного распространения. Обычно выбирают бумагу белого цвета. Вторая копия используется для кодирования и ввода данных. Она должна быть пригодна для копирования, поэтому цвет копии должен быть предпочтительно светло-желтым, а не розовым или синим. Третью копию отправляют в архив исследователя, и она также должна отличаться по цвету. Эта копия не предназначена для копирования, поэтому она может быть голубого или, что предпочтительнее, розового цвета.
Часто первую и вторую копии разделяют в процессе распространения информации. В этом случае важно, чтобы код пациента пропечатался на всех страницах, а номер Индивидуальной Регистрационной Карты печатался на каждой из них. Этот номер не должен совпадать с кодом пациента после рандомизации. Иногда предпочтительнее использовать разные бланки для проведения оценки в процессе вовлечения в исследование, чтобы не пришлось заводить новую карту на пациентов, которые окажутся неподходящими для исследования. Для того чтобы случайно не испачкать самокопирующуюся копию можно использовать специальные листы-подкладки.
Используемый материалГОСТР 52379-2005
http://cra-club.ru/content/view/199/
ГБОУ ВПО ТГМУ Минздрава России
Междисциплинарный комитет по этике
представления документов для этической экспертизы клинического исследования
1.Представление документов
Документация по планируемому клиническому испытанию подается в Комитет от лица заявителя, несущего ответственность за научный, организационный и этический аспекты исследования. Заявителем может быть ведущий врач-исследователь, компания-спонсор исследования, клиника, являющаяся клинической базой исследования.
Досье по планируемому клиническому исследованию, представляемое для этической экспертизы, должно включать все документы, необходимые для полноценной этической экспертизы. Документы должны быть представлены в бумажном формате в одном экземпляре в пластиковой папке с прозрачной первой страницей.
2.Сроки и адрес представления
Документы подаются в секретариат Комитета не позднее, чем за 2 недели до очередного заседания комиссии по адресу: Владивосток, пр. Острякова, 2; 1 этаж, научный отдел, секретарь Междисциплинарного комитета по этике Евсютина Ольга Леонидовна, тел. 245-17-06.
Материалы досье проходят предварительную этическую экспертизу у одного или нескольких специалистов по данной проблеме. Заключение специалиста подшивается в дело.
3.Досье должно включать следующие документы:
Заявление на экспертизу исследования.
Аннотация исследования, подписанная исполнителем и научным руководителем работы.
Протокол (дизайн) исследования, подписанный главным исследователем.
Копия регистрационного удостоверения лекарственного средства; документ о препарате международного образца или вкладыш в упаковку.
Индивидуальная регистрационная карта пациента.
Образец информированного согласия испытуемого (пациента).
Информация для испытуемого (пациента).
Список клиник, где проводится исследование.
Деловое письмо-согласие на проведение научных исследований на клинической базе, подписанное администрацией ЛПУ.
Брошюра исследователя – документ, подготовленный фармацевтической фирмой с целью информирования пациентов об изучаемом лекарственном средстве или методе лечения, находящемся в разработке.
Профессиональные автобиографии исследователя и его научного руководителя.
Отзыв специалиста по теме исследования.
Сертификаты исследователя по Качественной Клинической практике (GRP) и/или Качественной Лабораторной Практике (GLP), если таковые имеются.
Дневники, анкеты, которые предстоит заполнять пациентам-участникам исследования.
Материалы, включая рекламные, информирующие об исследовании и используемые для привлечения пациентов к участию в нем.
Отзыв специалиста (одного или нескольких) по данной проблеме.
Предыдущие решения отечественных комитетов по этике в отношении данного планируемого исследования, если таковые имеются.
По усмотрению заявителя могут быть дополнительно представлены и рассмотрены другие документы, имеющие значение для соблюдения этических норм в ходе планируемого исследования.
4. Оформление представления в секретариате
Секретариат Комитета регистрирует получение досье.
После получения досье секретариат в течение 2-х дней осуществляет следующие мероприятия:
формализует факт получения материалов на рассмотрение (вносит данные о поступившем на экспертизу планируемом исследовании в картотеку)
производит экспертизу полноты представленной документации и правильности ее оформления
при недостатках оформления и отсутствии необходимых документов ставит об этом в известность заявителя по телефону или факсу
при представлении документации за 2 недели до очередного заседания секретариат организует предварительную экспертизу содержания материалов досье, сообщает о ее результатах заявителю, доводит до его сведения вопросы, рекомендованные изменения и дополнения
в случае исправления недостатков оформления и предоставления необходимых документов в течение 2-х следующих дней вносит вопрос о рассмотрении материалов данного планируемого исследования в повестку дня очередного заседания.
Документы, необходимые для проведения этической экспертизы клинических исследований
Заявление на экспертизу исследования (форма 1).
Аннотация исследования, подписанная исполнителем и научным руководителем работы (форма 2).
Протокол (дизайн) исследования, подписанный главным исследователем (форма 3).
Копия регистрационного удостоверения лекарственного средства; документ о препарате международного образца или вкладыш в упаковку.
Индивидуальная регистрационная карта пациента.
Образец информированного согласия испытуемого (пациента) (форма 4).
Информация для испытуемого (пациента) (форма 5).
Список клиник, где проводится исследование (форма 6).
Деловое письмо-согласие на проведение научных исследований на клинической базе, подписанное администрацией ЛПУ (форма 7).
Брошюра исследователя – документ, подготовленный фармацевтической фирмой с целью информирования пациентов об изучаемом лекарственном средстве или методе лечения, находящемся в разработке.
Профессиональные автобиографии исследователя и его научного руководителя.
Отзыв специалиста по теме исследования.
Сертификаты исследователя по Качественной Клинической практике (GRP) и/или Качественной Лабораторной Практике (GLP), если таковые имеются.
Документы представляются в секретариат Междисциплинарного комитета по этике в бумажном варианте в пластиковой папке-скоросшивателе с прозрачным первым листом, без файлов. Документы должны быть вложены согласно списку предоставляемых документов указанных в заявлении (в таком же порядке).
Образец титульного листа
ГБОУ ВПО ТГМУ Минздрава России
Междисциплинарный комитет по этике
(должно соответствовать с протоколом и аннотацией)
Научные руководители: (полностью все регалии, а также научного консультанта, если он есть)
Исполнитель: (полностью Ф.И.О. аспирант (очный, заочный, соискатель и т.д.), кафедра, на которой выполняется исследование)
Телефон для контактов:
Принято к рассмотрению: «_____»______________ 20____г.
Дело рассмотрено на заседании (протокол № __ от «___»________20__г.)
Ответственный секретарь Междисциплинарного комитета по этике ГБОУ ВПО ТГМУ Минздрава России» ____________/Бондарева Ж.В./
Председателю Междисциплинарного комитета по этике
ГБОУ ВПО ТГМУ Минздрава России
профессору д.м.н. Невзоровой В.А.
от очного (заочного) аспиранта//или докторанта//
или соискателя ученой степени к.м.н./д.м.н.
ГБОУ ВПО ТГМУ Минздрава России
Прошу провести этическую экспертизу научного исследования
(Ф.И.О. ученая степень, ученое звание, занимаемая должность)
Планируемые сроки проведения исследования: ________________________
Перечень представленных документов:
Аннотация исследования, подписанная исполнителем и научным руководителем работы.
Протокол (дизайн, схема) исследования.
Индивидуальная регистрационная карта пациента.
Информированное согласие пациента.
Информация для пациента.
Список клиник, где планируется проводить исследование.
Деловое письмо-согласие на проведение научных исследований на клинической базе, подписанное администрацией ЛПУ.
Профессиональная автобиография исследователя.
Профессиональная автобиография руководителя темы.
Отзыв специалиста по теме (если имеется).
Предварительная экспертиза члена Междисциплинарного комитета по этике.
научно-исследовательской работы на тему «_____тема__________»
специальность: шифр и название специальности
Научный руководитель: д.м.н. профессор ____________
Исполнитель: очный аспирант кафедры _______________ Семенов Николай Иванович
Научный руководитель д.м.н. профессор ФИО __________________
Исследователь _____________________ ФИО __________________
ПРОТОКОЛ (дизайн, схема) исследования
Указать общую длительность исследования, его этапы.
Должны быть представлены материалы, отражающие ход исследования:
контингент обследуемых, количество пациентов, принимающих участие в клиническом исследовании, возрастной и половой состав. Нужно обязательно указать так называемые «уязвимые» контингенты (беременные, дети, заключенные, больные психическими заболеваниями, недееспособные, военнослужащие срочной службы, больные пожилого и старческого возраста). Запрещается проведение экспериментов на больных, заключенных или военнопленных;
критерии включения и исключения пациентов;
набор и учет пациентов, принцип формирования групп, контрольных групп, их численность;
длительность исследования и его промежуточных этапов;
описание процедур исследования;
предсказуемые побочные эффекты и неудобства.
Дать образцы используемых стандартных опросников или анкет.
Указать методы статистической обработки материала
При исследовании материала, полученного в ходе оперативных вмешательств указать приказ об обязательном морфологическом и гистологическом исследовании материала, согласие лечебного учреждения на использование материала в научных целях, при необходимости – согласие пациента;
При проведении доклинических исследований после обоснования цели исследования указать предполагаемое число и вид животных в эксперименте, число животных в группах должно быть минимальным (желательно 5), указать способ содержания и кормления животных, способ умерщвления (должен быть гуманным).
Разделы, которые должны быть отражены в протоколе исследования, при использовании лабораторных животных
объект исследование (вид животного)
количество животных с обоснованием необходимого их числа
условия содержания животного, продолжительность содержания
репродукция (если предусмотрено). Указать дальнейшую судьбу приплода, участие его в экспериментах.
детальное и пошаговое описание воздействия на животное.
Методы, используемые в процессе эксперимента:
на подготовительном этапе:
введение химических веществ, пищевых добавок, физико-механические воздействия и др.
на основном этапе:
способ забора экспериментального материала, перечень забираемого материала, предусмотрено ли умерщвление животного, если да, то каким способом
Необходимо предоставить описание проводимой анестезии, вид, используемые препараты.
на заключительном этапе (использование животного после эксперимента, утилизация останков)
Отразить соответствующие критерии необходимости использования лабораторных животных в данной научной работе:
применение техники неотложных оперативных вмешательств, необходимых для последующей работы в клинике, что не может быть обеспечено другими способами;
применение интубации, управляемого дыхания и наркоза, осуществимых только на живом объекте;
применение способов остановки кровотечения, разъединения и соединения живых тканей, обладающих естественной сократимостью, эластичностью, смещаемостью (подвижностью) и регенераторной способностью, что не может быть воспроизведено
другими способами или на иных объектах;
применение хирургических операций и инвазивных манипуляций в условиях, максимально приближенных к реальности при одновременном исключении фактора риска для жизни и здоровья человека при отсутствии адекватных замещающих
способов;
выполнение фундаментальных научных исследований, требующих экспериментального подтверждения, проведение экспериментального этапа доклинических испытаний, направленных на получение результатов, не достижимых другими средствами (разработка новых или улучшение существующих способов лечения, разработка технологии или получение знаний для разработки нового
эффективного способа лечения, диагностики или выяснения этиопатогенеза заболевания и т.п.)
Информированное согласие - процесс добровольного подтверждения пациентом его согласия участвовать в том или ином исследовании после того, как он был ознакомлен со всеми аспектами исследования. Информированное согласие документируется с помощью письменной подписанной и датированной формы информированного согласия (ICH Harmonised Tripartite Guideline for GCP).
Потенциальные испытуемые должны быть информированы о целях и методах исследования, лекарственном средстве и курсе лечения, об имеющихся альтернативных курсах лечения, потенциальной пользе и риске, а также о возможных осложнениях и неудобствах, которые может принести участие в исследовании.
Основываясь на полученной и понимаемой информации, потенциальный испытуемый дает добровольное согласие на участие в исследовании. Согласие пациента не может быть получено путем какого-либо принуждения. Испытуемый должен знать, что в любое время он имеет право выйти из исследования и выход из исследования не окажет влияния на его дальнейшее медицинское обслуживание.
При участии детей (до 14 лет) необходимо получить согласие их родителей/усыновителей. Родителям/усыновителям предоставляется Информационный листок пациента (для родителей) с формой информированного согласия. где представлена полная, объективная, достоверная, адаптированная информация. Достаточно, чтобы форму информированного согласия подписывал один из родителей. В случае возникновения конфликта согласий - одного из родителей или ребенка - следует воздержаться от включения такого пациента в исследование.
Отдельный Информационный листок пациента с формой информированного согласия выдается несовершеннолетнему ребенку с 14 лет. Эту форму информированного согласия дети подписывают наряду с родителями/усыновителями. Ребенок должен получить полную и необходимую информацию для принятия осознанного решения об участии в исследовании. При этом содержание документа должно быть максимально адаптировано к пониманию ребенка.
Образец информированного согласияпациентана участие в клиническом исследовании
(Ф.И.О. пациента или его законного представителя)
в соответствии со статьями 20, 22, 23 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации» от 21 ноября 2011 г. N 323-ФЗ (ред. от 21.07.2014), получил полную информацию обо всех аспектах планируемого исследования название исследования .
Я получил(а) информацию о целях и сущности клинического исследования название исследования. сведения об этой методике лечения, ожидаемой его эффективности и безопасности, о пользе и степени риска при участии в исследовании, о своих правах и обязанностях. Я предупрежден(а) о возможных нежелательных и побочных явлениях и моих действиях в случае возникновения непредвиденных эффектов при проведении название исследования.
Я имел(а) возможность обсудить с врачом-исследователем все интересующие меня вопросы и удовлетворен(а) полученными ответами.
Я информирован(а) о том, что буду включен(а) в исследование только после того, как пройду полное, в соответствии с Протоколом, обследование и мое физическое состояние будет соответствовать условиям включения в данное исследование.
Я добровольно и осознанно соглашаюсь принять участие в исследовании название исследования. извещен(а), что имею право отказаться от участия в исследовании или в любой момент прекратить участие в данном исследовании без объяснения причин.
Я согласен(на) выполнять инструкции, добровольно сотрудничать с врачом-исследователем и немедленно сообщать ему о любых изменениях моего здоровья.
Я получил информацию о том, что могу, не объясняя причин, отказаться от участия в исследовании на любом его этапе.
Подписывая форму Информированного согласия, я даю разрешение на использование результатов моего обследования для научного исследования. Я согласен на публикацию данных с соблюдением конфиденциальности.
ФИО пациента Дата Подпись
ФИО исследователя Дата Подпись
Информация для пациента
Информация для пациента должна включать следующие сведения:
добровольность участия в исследовании и возможности прервать его в любое время;
характеристика целей и задач исследования, его продолжительность;
характеристика предмета исследования (например, лекарственного средства), механизма его действия, его предполагаемых и уже доказанных свойств и пр.;
схема исследования, вероятность попадания испытуемого в контрольную группу;
ожидаемая польза от участия в исследовании;
риск, связанный с исследованием, неудобства и дополнительная нагрузка по сравнению с традиционной терапией (например, за счет дополнительных методов обследования);
обязанности пациента в ходе исследования, необходимость отказа от использования других лекарственных средств, определенных пищевых продуктов и пр. Особо следует осветить проблематику участия в исследовании беременных женщин и кормящих матерей, рисков для них, плода, грудных детей;
планируемые расходы пациента, если таковые ожидаются, связанные с участием в исследовании;
контактные адреса и телефоны, по которым испытуемый может получить дополнительную информацию;
информация о конфиденциальности сведений об испытуемом.
Список клинических центров (баз), где планируется проводить
исследование «__тема __»
Полное наименование учреждения (например: ГБОУ ВПО ТГМУ Минздрава России, КГБУЗ ВКБ №2, Клиника ….)
Юридический и фактический адреса учреждения
Контактные телефоны учреждения
Деловое письмо-согласие на проведение научных исследований на клинической базе, подписанное администрацией ЛПУ
Главному врачу название ЛПУ
от очного аспиранта кафедры название кафедры
ФИО аспиранта (исследователя)
Прошу Вашего согласия на проведение на базе название ЛПУ научного исследования «Тема исследования ». Исполнитель исследования: ФИО, должность. Научный руководитель: ФИО, должность.
«___» _________ 20____г.
Резолюция главного врача название ЛПУ :
Проведение научного исследования «Тема исследования »
«___» _________ 20____г.
Подпись главного врача _____________
Похожие работы:представления. экспертизы ; действующие нормативные и методические документы по судебно-медицинской экспертизе ; правила оформления медицинской документации; порядок. для эмбриологических и клиническихисследований ; современные методы лабораторных исследований.
регламентирующих документов. этическойэкспертизе научных исследований. методологии научных исследований и др. проведение обучающих семинаров для. ІІ – внутривузовский). Порядок и условия проведения: І. Представление обзоров литературы, описаний клинических.
клиническиеисследования. Практика экспертной деятельности (Васильев А.Н. – директор Центра экспертизы. Порядок регистрации медицинских изделий. Порядок оформления документовдля. Правовые и этические механизмы розничной. Федерации) Представление проекта «.
Лекции: Введение. Модели взаимоотношения врач-пациент по Роберту Витчу. Этические правила и правовые вопросы взаимоотношения врач-пациентисследований. публикаций в научной литературе, использования этих сведений в учебном процессе и в иных целях. Представление. порядок. для многих последующих международных документов. этических комитетов при экспертизе протокола клиническихисследований.
клиническихисследований. анализа решений и управления результатами лечения, включающие методологию регулирования риска. Для. экспертизе КМП, закрепленные соответствующими нормативными документами. Экспертиза. исследования операций и современных представлений.
Компания OCT оказывает услуги по написанию и редактированию следующих основных документов клинического исследования:
Брошюра исследователя (БИ). БИ — это сводное изложение результатов доклинического исследования и клинического исследования лекарственного препарата для медицинского применения.Документ, в котором содержится обзор данных, полученных в ходе доклинического исследования.
Компания OCT разработала собственный продукт — MATRIX EDC. систему управления данными, которая прошла полный цикл валидационных проверок на предмет соответствия стандарту 21 CRF часть 11 и подходит для применения в клинических исследованиях с обработкой данных ИРК как в электронной, так и в бумажной формах.
Написание всей документации осуществляется специалистами, обладающими опытом работы в научной, медицинской и статистической областях. Подготовленные нами документы соответствуют всем применимым принципам Надлежащей клинической практики (GCP). выработанным на Международной конференции по гармонизации (ICH). а также нормативным требованиям государственных органов. Медицинские писатели OCT работают в тесном сотрудничестве с регуляторным отделом OCT и обладают большим опытом разработки дизайна исследований для различных типов лекарственных препаратов для медицинского применения, в том числе для биоаналогов и биоулучшителей.
Наши медицинские писатели принимали участие в более чем 200 клинических исследованиях. Все документы для них были успешно одобрены государственными органами в странах деятельности OCT. За нашими плечами — успешный опыт подготовки и подачи в регуляторные органы многочисленных отчетов о клинических исследованиях.
Мы оказываем услуги по написанию медицинской документации как в отдельном порядке, так и в составе пакета услуг в рамках проведения клинического исследования. Наши квалифицированные и сертифицированные переводчики выполняют переводы на русский язык, действуя в соответствии со стандартными операционными процедурами компании. Для выполнения переводов на другие языки мы привлекаем внештатных специалистов.