









 Рейтинг: 4.1/5.0 (1851 проголосовавших)
Рейтинг: 4.1/5.0 (1851 проголосовавших)Категория: Инструкции
Ниже приведены сведения о приготовлении питательных сред и вспомогательных материалов, а также даны указания по посеву и режиму выращивания 'на различных средах.
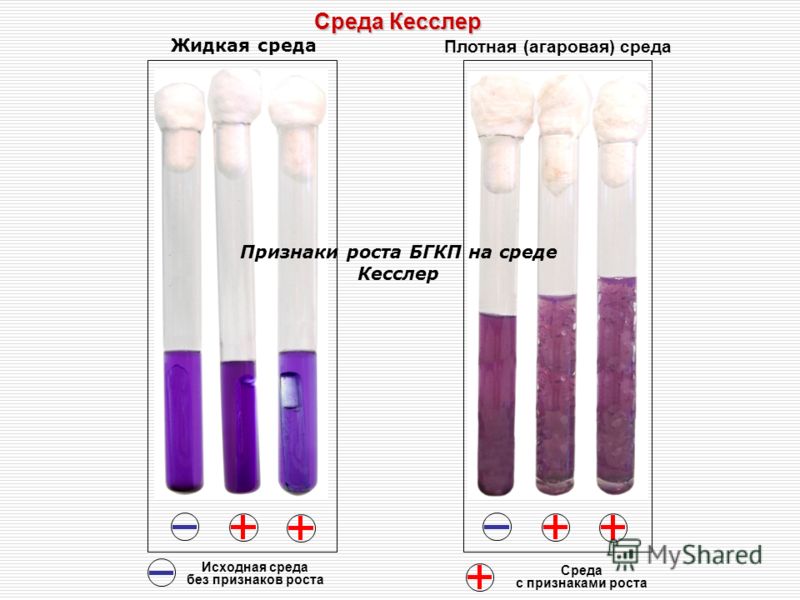
Для приготовления среды Кесслера (модифицированной) требуется: питьевая вода 1 л, пептон 10 г, бычья желчь свежая 50 мл, лактоза 2,5 г, 1%-ный водный раствор генциан-виолета/2 мл. В воду добавляют пептон и желчь и все это кипятят при размешивании в течение 20—30 мин, после чего фильтруют через вату, раство- ряк>т лактозу, доводят объем до 1 л, устанавливают реакцию среды (рН 7,4—7,6), добавляют генциан-виолет, разливают в пробирки и стерилизуют при 1 ат в течение 15 мин.
Вместо среды Кесслера можно использовать среду Краевской, применяя следующие материалы: бычью желчь 1 л, пептон Ш г, лактозу 10 г, 1%-ный водный раствор генциан-виолета 4 мл. Чистую свежую желчь фильтруют через ватный фильтр, стерилизуют при 1 ат в течение 10 мин и вторично фильтруют через ватный фильтр. К фильтрату добавляют лактозу и пептон: смесь нагревают в текучем пару 10 мин, после чего добавляют генциан-виолет в количестве 4 мл на 1 л среды, разливают в пробирки и стерилизуют в автоклаве при 1 ат в течение 15 мин.
Посев производят по 1 мл разведенного мороженого в пробирки со средой Кесслера или Краевской. Затем перемешивают, избетая образования пузырьков газа. Режим выращивания — в термостате температурой 42—43° С на 48 ч. При отсутствии признаков брожения (газообразования) через 48 ч мороженое считают не загрязненным кишечной палочкой. При наличии газообразования производят высев на среду Эндо для установления принадлежности бактерий, вызвавших брожение, к определенному виду.
Для приготовления среды Эндо необходимы следующие материалы: мясопептонный агар (рН 7,6—7,8) 1 л, лактоза 10 г, фуксин основной (насыщенный спиртовой раствор) 5 мл, натрий сернокислый (10%-ный водный раствор) 25 мл. Раствор лактозы и сернисто- кислого натрия стерилизуют по отдельности в аппарате Коха при 100° С в течение 1 ч. Из фуксина и свежеприготовленного раствора сернистокислого натрия приготовляют отдельную смесь, которая должна быть прозрачной, бледно-розового цвета. Перед употреблением смесь постепенно приливают к лактозному агару, избегая вспенивания, и разливают в чашки Петри. При изготовлении среды Эндо особенно строго соблюдают требования стерильности (посуда, вода), так как среда после ее приготовления не стерилизуется. Высев в чашки Петри со средой Эндо производят из числа забродивших пробирок. Высев делают с расчетом получить отдельные колонии. Режим выращивания — в термостате температурой 37° С в течение 18—24 ч. Чашки помещают в термостат крышками вниз. При отсутствии на среде Эндо колоний, типичных для группы коли (красных с металлическим блеском или без блеска; розоватых и выпуклых, слизистых), продукт считают не загрязненным кишечной палочкой. При наличии на среде Эндо колоний, типичных для группы коли, а также бесцветных, характерных для В. Paracoli, выделяют из колоний чистые культуры, микроскоп и р уют и идентифицируют их.
Мясопептонный агар используют для приготовления среды Эндо. В мясопептонный бульон добавляют 1,5—2% агара, кипятят до расплавления, после чего добавляют 1 % дрожжевого авто- лизата, перемешивают до растворения, фильтруют через вату, разливают в пробирки и стерилизуют; при употреблении бульона из мясного экстракта стерилизацию проводят при 1 ат в течение 20 мин, а при использовании бульона из мясокостной муки стерилизуют текучим паром в течение трех дней, по 20 мин каждый день.
Молочно-сывороточный агар получают следующим образом. Обезжиренное молоко нагревают до 40° С, добавляют сычужный порошок (0,1 г), выдерживают 1 ч при той же температуре. Образовавшийся сгусток разбивают стеклянной палочкой, нагревают смесь до 80° С, процеживают через редкий холст, устанавливают реакцию среды (рН 6,8—7,0). В полученную сыворотку (1 л) до- бавляюЦ пептон (10 г) и агар (15 г), расплавляю? в автоклаве при 1 ат в течение 15 мин, фильтруют, разливают в пробирки и стерилизуют при 1 ат в течение 15 мин.
Дрожжевой автолизат в количестве 1 % входит в состав мясопептонного агара, а также используется для приготовления мясопептонного бульона. Прессованные дрожжи смешивают с равным по массе количеством воды до получения однородной массы, ставят в Термостат при 50—55° С на 3 суток. После этого массу помещают в! автоклав при 0,8 ат на 15 мин, затем несколько раз фильтруют, осадок промывают водой с таким расчетом, чтобы общее количество фильтрата составило 4 л. Фильтрат нейтрализуют до рН 6,8, разливают мелкими порциями и стерилизуют в автоклаве при 1 ат в течение 15 мин.
Мясопептонный бульон является основным продуктом для приготовления мясопептонного агара, а также используется для приготовления различных сред в микробиологической практике. Этот бульон можно приготовить из мясного экстракта или из мясокостной муки. При наличии мясного экстракта смесь из 1 л воды питьевой, 10 г пептона, 10 г мясного экстракта, 100 г дрожжевого автолизата и 5 г поваренной соли (при нормальной реакции среды рН' 7,2—7,4) тщательно перемешивают, нагревают до кипения, фильтруют через складчатый фильтр, разливают в пробирки (по 5 мл) и стерилизуют при 1 ат в течение 10 мин. Для приготовления бульона из мясокостной муки смесь из 1 л воды питьевой, 200 г мясокостной муки, 100 г дрожжевого автолизата, 3 г панкреатина (или поджелудочной железы, провернутой в количестве 25—30 г через мясорубку), 2 г соды двууглекислой и 10 мг хлороформа помещают в бутыль, хорошо смешивают, плотно укупоривают, выдерживают 3—4 дня в термостате при 37° С или 6—7 дней при комнатной температуре, ежедневно взбалтывают. По истечении указанного срока смесь фильтруют-через вату и марлю, остаток промывают 200 мл воды; фильтрат разливают в бутылки, стерилизуют при 1 ат в течение 20 мин, затем сразу же фильтруют через бумажный складчатый фильтр, разливают по 200 мл в бутылочки и вторично стерилизуют; хранят до употребления.
Питательный бульон готовят из крепкого бульоиа по следующей рецептуре: вода питьевая 1 л, крепкий бульон 200 мл и поваренная соль 0,5%. Устанавливают реакцию феды рН 7,2—7,4. Перед использованием бульон разливают в пробирки по 5 мл и стерилизуют при 1 ат в течение 10 мин.
Для приготовления среды Симмонса необходимо иметь раствор Козера и индикатор. В раствор Козера входит: натр — аммоний фосфорнокислый 1,5 г, калий фосфорнокислый одноосновной 1 г магний сернокислый 0,2 г, натрий лимоннокислый 2,5—3 г, вода дистиллированная 1 л. В качестве индикатора используют бромтимол- блау — 0.5%-ный спиртовой раствор. К раствору Козера добавляют 2% агара, доводят реакцию среды до рН 7,2.—7,4 и стерилизуют в автоклаве при 1 ат в течение 15 мин. К незастывшей среде добавляют индикатор, разливают в стерильные пробирки и устанавливают их после посева в наклонном положении. Для приготовления среды с лактозой необходимо: в 1%-ном растворе пептона (рН 7,2—7А) растворить 0,25% лактозы и добавить несколько капель индикатрра Ан- дреда, разлить в пробирки и стерилизовать в аппарате К^ха при 100° С по 20 мин в течение 3 дней или в автоклаве при 1 ат в течение 15 мин. Индикатор Андреда приготовляют следующим образом: 1 г фуксина кислого, 32 мл нормального раствора едкого натра я дистиллированную воду смешивают, настаивают при комнатной температуре 3 дня, после чего фильтруют и стерилизуют текучим /паром по 30 мин в течение 3 дней.
Из бульона с чистой культурой от подозрительной колонии, выросшей на среде Эндо, производят посев на среду с лактозой для выделения В. Paracoli и на среду Симмонса — для выделений В. A§roge- nes. Посев производят пипеткой емкостью 1 мл в количестве трех капель. Пробирки с посевами помещают в термостат температурой 37° С на 24 ч. При наличии В. Аёгодепеэ среда Симмонса в присутствии индикатора бромтимолблау нз светло-оливково-зеленоватой ста-, ловится светло-синей. Отсутствие газа и кислот реакции среды с лактозой характерно для В. Paracoli.
Фуксин кислый используют в виде основного и в виде рабочего растворов. Для приготовления основного раствора фуксин в количестве 1 г растирают в ступке с 10 мл 96%-ного этилового спирта, к полученной массе добавляют 5 г кристаллической карболовой кислоты, непрерывно растирая, постепенно прибавляют 100 мл воды. Рабочий раствор готовят перед употреблением; для этого часть основного раствора разбавляют в 5—10 раз дистиллированной водой.
Раствор Люголя получают путем растворения в 5 мл воды 2 г йодистого калия; добавляют 1 г йода и после его растворения добавляют 300 мл воды. Раствор сохраняют в темном месте.
Генциан-виолет готовят следующим образом. 1 г генциан- внолета растворяют в 10 мл 96%-ного этилового спирта, полученный раствор выливают в 100 мл 5%-ного раствора очищенной карболовой кислоты.
Краску для препаратов приготовляют так. Спирт этиловый 96%-ный в количестве 300 мл и 30 г метиленовой сини сухой размешивают и ставят в термостат температурой 30° С на 24 ч. К 100 мл водного раствора калиевой щелочи (0,01%) добавляют 30 мл приготовленной смесн. Для получения водного раствора метиленовой снни к 5 мл спиртового раствора прибавляют 195 мл дистиллированной воды.
Сусловый агар готовят следующим образом. Свежее неохме- ленное сусло вдвое разводят водой, прибавляют 2% агара и расплавляют при 1 ат в течение 15 мин, фильтруют, разливают в пробирки и стерилизуют при 1 ат в течение 15 мин.
Цельное молоко свежее разливают высоким слоем в пробирки н стерилизуют при 1 ат в течение 15 мин.
Для приготовления стерильной воды используют водопроводную или другую питьевую воду в пробирках по 10 мл\ стерилизацию проводят в автоклаве при 1 ат в течение-15 мин.
Изучение специфической активности питательных сред
Для получения сведений о специфической активности разработанных питательных сред для индикации санитарно-показательных микроорганизмов были проведены контрольные испытания на средах с использованием музейных тест штаммов. При культивировании колиформных бактерий и E.coli в исследуемых жидких питательных средах установлено наличие характерного визуально видимого роста микроорганизмов (диффузное помутнение, изменение цвета среды и газообразование) через 18 – 48 ч при температуре 37 ?С из разведений 10 -6 и 10 -7. что подтверждает высокую чувствительность.
Способность термотолерантных колиформных бактерий (ТКБ) ферментировать лактозу до кислоты и газа при температуре (44?1) ?С в течение 24-48 ч, определяли на средах Эйкмана и Кесслера-ГРМ.
Кроме того, в отличие от контрольной среды Эйкмана Eijkman Lactose Broth (HiMedia), разработанные среды Эйкмана с глюкозой и лактозой содержат индикатор бромтимоловый синий, что дает возможность более правильно интерпретировать результаты анализа.
Ингибирующие свойства питательных сред Кесслера-ГРМ, SDS-бульона проверяли на музейных тест-штаммах: S.aureus Wood-46,P.vulgaris НХ 19 222. Анализ результатов подтвердил ингибицию при всех испытанных концентрациях (10 -1. 10 -4. соответственно).
Исследования, касающиеся железо-глюкозо-лактозного агара с мочевиной, показали, что железо–глюкозо–лактозный агар, содержащий в своем составе мочевину, позволяет различать иерсинии вследствие неодинаковой способности её расщеплять. Нами была исследована возможность использования железо–глюкозо–лактозного агара с мочевиной для дифференциации Y.pseudotuberculosis и Y.enterocolitica от Y.pestis .
Большое значение для санитарной оценки внешней среды (воды, пищевых продуктов) имеет обнаружение возбудителя холеры (Vibriocholerae). При лабораторной диагностике отобранные подозрительные на холерный вибрион колонии, выросшие после сред накопления на дифференциально-диагностических питательных средах, отсевают на лактозно-сахарозную среду, среду Клиглера или среду Кристенсена. Нами была исследована возможность использования железо–глюкозо–лактозного агара с мочевиной для дифференциации типового вида рода V.cholerae по признаку ферментации глюкозы без образования газа.
Было доказано, что питательная среда обеспечивает во всех засеянных пробирках рост каждого штамма с проявлением типичных биохимических свойств: утилизацию мочевины, ферментацию лактозы и глюкозы, газообразование, образование сероводорода.
Принцип действия флюорогенного селективного бульона (ФСБ) основан на выявлении специфических ферментов ?-глюкуронидазы и триптофаназы E.coli. Кишечная палочка расщепляет флюорогенный субстрат 4-метилумбеллиферил -?-Д- глюкуронид (МУГ), в результате образуется флюоресцирующий в УФ-свете (366 нм) продукт реакции, а обнаружение индола, (вследствие расщепления триптофана) при добавлении реактива Ковача позволяет выявить E.coli с надежностью 99,9 %.
При исследовании ростовых свойств E.coli и колиформных микроорганизмов из разведения 10 -7 через 18 ч инкубации при температуре 37 ?С наблюдалось диффузное помутнение, газообразование, наличие флюоресценции в УФ-свете (366 нм). Рост грамположительных микроорганизмов подавлен.
Степень интенсивности голубой флюоресценции, характерной для E.coli при ультрафиолетовом облучении микробного роста визуально ярче выражена на предлагаемой среде ФСБ, чем на среде Fluorocult BRILA Broth (FBB). Данный факт подтвердился и в результате сравнения интенсивности флюоресценции с помощью многофункционального планшетного анализатора VICTOR? (Wallac 1420), производящим измерения с использованием флуориметрии со следующими режимами: umbelliferone; CW-lamp filter name F355; Emission filter name F460; Measurement time 0.1s.(рисунок 1).
Рис. 1. Показатели интенсивности свечения флюорогенного селективного бульона (ФСБ) в сравнении с показателями среды Fluorocult BRILA Broth (FBB).
Определение сроков годности питательных сред
При разработке питательных сред были необходимы исследования их характеристик в процессе длительного хранения для определения сроков их годности. Качество экспериментальных серий питательных сред в процессе хранения их при различных температурах оценивали по физико-химическим и биологическим показателям.
Эксперимент по определению срока годности разрабатываемых сред Эйкмана с лактозой и глюкозой, Кесслера-ГРМ, SDS-бульона показал, что особо значимых изменений качественных показателей сред при хранении в течение 36 месяцев не выявлено по сравнению с исходными образцами. По совокупности полученных результатов было доказано, что среды имеют гарантированный срок годности 2 года.
Исследованиями установлено, что питательная среда для идентификации энтеробактерий (железо–глюкозо–лактозного агара с мочевиной) с предложенной технологией подготовки компонентов в течение 18 месяцев не теряет своих физико-химических и биологических свойств, что соответствует гарантийному сроку хранения - 1 год.
Использование экспресс анализаторов «Бак Трак 4100» для оптимизации составов и оценки качества сред Эйкмана
Так как разрабатываемые среды Эйкмана по своим свойствам соответствуют требованиям, предъявляемым к импедансным питательным средам (абсолютная прозрачность и оптимальный ионный состав), нами исследована возможность использования приборов типа «Бак Трак 4100» для определения качества сред Эйкмана по показателям чувствительности и скорости роста E.coli в исследуемых образцах в сравнении со средой Eijkman Lactose Broth (пр-во HI MEDIA) (рисунок 2).
На рисунке 2 приведены типичные кривые импедансного сигнала при определении E.coli с использованием сред Эйкмана с лактозой и глюкозой в сравнении со средой Eijkman Lactose Broth. Видно, что эффективность и скорость роста кишечной палочки на разработанных средах Эйкмана по сравнению со скоростью роста на контрольной среде выше, что подтверждено классическим методом высева на плотные питательные среды.
Кроме того, при росте тест-штаммов наблюдалось изменение цвета питательной среды с исходного зеленого на желтый, что дополнительно позволяет исключить вариабельность интерпретации результатов по сравнению с контрольной средой Eijkman Lactose Broth без индикатора. Таким образом, использование прибора для определения эффективности, скорости роста накопительных сред на примере сред Эйкмана, позволяет исключить рутинный классический метод.

Рис.2. Кривые импедансного сигнала при определении E.coli с использованием сред Эйкмана с лактозой и глюкозой в сравнении с аналогом.
Применение радиационного метода стерилизации и индивидуальной упаковки для сред Эйкмана
В отечественной промышленности отсутствуют сухие накопительные питательные среды в стерильной расфасовке для непосредственного внесения в определенный объем воды при использовании в полевых условиях. Нами предложен алгоритм подготовки сред Эйкмана для эпидемиологического мониторинга, который включает одноразовую индивидуальную упаковку и стерилизацию ?- облучением. Сухие среды Эйкмана с лактозой (глюкозой), рассчитанные на исследование 100 мл воды, были расфасованы и герметично укупорены во флаконы из полистирола и стекла для стерилизации ?-облучением на кобальтовой стационарной водоохлаждаемой установке КСВ-500. Экспериментально установлена оптимальная минимальная доза в 5 кГр, достаточная для стерилизации сухих питательных сред.
Таким образом, сухие питательные среды Эйкмана с лактозой (глюкозой) в индивидуальной упаковке имеют дополнительное преимущество: просты и удобны в приготовлении для использования в стационарных и передвижных лабораториях и могут быть рекомендованы для применения в практику здравоохранения для повышения эффективности эпидемиологического мониторинга объектов внешней среды (воды).
Разработка нормативной документации
В связи с необходимостью совершенствования диагностики возбудителей кишечных инфекций на питательных средах нами были разработаны ТУ, регламенты производства, инструкции по применению для установления единых норм, требований и показателей качества питательных сред, а также единых методов испытания этих показателей и требований к упаковке, маркировке, транспортированию, хранению. Результатом разработки нормативной документации является внедрение в производство усовершенствованных питательных сред.
Разработка методических рекомендаций
В России широко применяется методология обнаружения и выявления БГКП с применением бактериологических питательных сред лабораторного изготовления при санитарно-микробиологическом исследовании объектов внешней среды, пищевых продуктов, оборудования предприятий пищевой промышленности, для оценки санитарного состояния лечебных учреждений, учреждений общественного питания и т.д.
Разработан проект методических рекомендаций по использованию усовершенствованной, сухой питательной среды Эйкмана с лактозой при санитарно-микробиологическом анализе воды для обнаружения колиформных бактерий и E.coli. Присутствие и подсчет количества общих колиформных бактерий (ОКБ) и термотолерантных колиформных бактерий (ТКБ) определяют титрационным методом (методом бродильных проб), который может быть использован при отсутствии материалов и оборудования для выполнения анализа методом мембранной фильтрации; при анализе воды с большим содержанием взвешенных веществ; в случае преобладания в воде посторонней микрофлоры, препятствующей получению на фильтрах изолированных общих колиформных бактерий. Метод основан на накоплении бактерий после посева установленного объема воды в жидкую питательную среду с последующим пересевом на плотную дифференциальную среду с лактозой и идентификации колоний по культуральным и биохимическим тестам. Для ускорения выдачи ответа на присутствие ТКБ рекомендовано производить высев 1 мл из объемов среды Эйкмана, где отмечено помутнение, газообразование и изменение цвета среды, в пробирки со средой Эйкмана, предварительно прогретой до 44 ?С, с поплавками. Посевы выдерживают в термостате при (44±1) ?С в течение (24±2) часов. При обнаружении кислоты и газа выдают положительный ответ.
Испытание разработанных питательных сред в баклабораториях
На завершающем этапе работы образцы разработанных питательных сред были совместно испытаны на базах микробиологических лабораторий.
При исследовании проб из водоисточников на ТКБ с использованием разработанных сред Эйкмана с лактозой и глюкозой на базе микробиологической лаборатории ФГУЗ «Центр гигиены и эпидемиологии в Калужской области» было отмечено, что испытуемые среды при различных температурах инкубирования (37 и 44) ?С в течение 24 ч. дают характерный рост БГКП. Выявляемость энтеробактерий 100 %.
Испытания сред Эйкмана с лактозой проводились при санитарных обследованиях предприятий общественного питания, воды поверхностных водоемов и сточных вод, пищевых продуктов (молоко и молочнокислые продукты, кондитерские изделия с кремом). Всего было исследовано 623 молочных продукта, в 68 были обнаружены БГКП; 756 смывов – из них 120 положительных находок; 46 поверхностных водоемов – 8 находок; 30 колодцев и родников – 12 положительных находок. На среде Эйкмана с глюкозой общее количество исследований - 756 из них 128 положительных находок при 100 % совпадении с контрольными средами.
Проведенные испытания качества питательных сред Эйкмана в ФГУЗ «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора показали, что выявляемость энтеробактерий в исследуемых образцах воды на средах Эйкмана с глюкозой и лактозой также составила 100 %, скорость роста энтеробактерий на испытуемых средах сопоставима со скоростью роста на контрольной среде Кесслера-ГРМ, биохимические и культуральные свойства микроорганизмов стабильны. Чувствительность сред Эйкмана с глюкозой и лактозой (при посеве 19 штаммов энтеробактерий, в том числе в посевной дозе <10 2 микробных клеток, инкубации в течение 24 – 48 часов) составила 100 %.
При испытании среды Кесслера-ГРМ в качестве контроля использовалась среда Кесслера лабораторного изготовления. Посев материала осуществлялся на среды с соблюдением условия равнозначности. Посевы инкубировались при температурах (37 и 43)?С в течение 24 ч.
По результатам апробации среды Кесслера ГРМ, проведенной в централизованной микробиологической лаборатории ФГУЗ «Центр гигиены и эпидемиологии в Тульской области», было отмечено, что при посеве исследуемых образцов как в экспериментальную среду, так и в среду лабораторного изготовления отмечался рост в виде помутнения и образования газа при наличии БГКП (таблица 2).
Аналогичные испытания среды Кесслера-ГРМ были проведены в лаборатории ФГУЗ «Центр гигиены и эпидемиологии по Калужской области». Было исследовано 2175 проб в виде смывов, пищевых продуктов и т. д. В ходе исследований установлено, что выявляемость культур на среде Кесслера – ГРМ выше по сравнению с контрольной и составляет 103 % (таблица 3).
Таблица 2 - Результаты проверки качества среды Кесслера-ГРМ
Результаты проведенных исследований на всех базах показали, что среда Кесслера-ГРМ проста, удобна в приготовлении, стандартна, обладает высокой чувствительностью в отношении БГКП.
Испытания SDS-бульона по микробиологическим показателям (по выявляемости энтеробактерий в образцах воды, смывов и др.), были проведены в Центре Госсанэпиднадзора г.Серпухова и в лаборатории ФГУЗ «Центр ГиЭ по Калужской области» (таблица 4).
Таблица 4 - Выявляемость энтеробактерий на SDS-бульоне (по результатам на двух базах).
Выявленные штаммы при испытаниях
Испытуемая среда SDS-бульон
Контрольная среда Кода
Количество положительных находок энтеробактерий, в т. ч.
Выявляемость энтеробактерий, % в т. ч.
В результате проведенных экспериментов установлено, что по чувствительности, скорости роста энтеробактерий, ингибирующим свойствам в отношении микробов – ассоциантов, сохранности основных биологических показателей выделенных энтеробактерий испытуемая среда SDS-бульон идентична контрольной - среде Кода (филиал ФГУП НПО «Микроген» г. Махачкала). Но по выявляемости энтеробактерий разработанная среда показала преимущество перед контрольной средой - 116.1 %.
Испытания железо-глюкозо-лактозного агара с мочевиной, проведенные в лаборатории ФГУЗ «Центр гигиены и эпидемиологии в Тульской области» с использованием музейных, свежевыделенных штаммов, биоматериала от больных, шовного и перевязочного материала при исследовании его на стерильность, показали хорошие идентифицирующие свойства и предпочтительное ее использование перед средой Клиглера, (выявлено на 4 находки больше или 122 %, вследствие дополнительного теста по расщеплению мочевины) (таблица 5).
Таблица 5 - Выявляемость энтеробактерий на испытуемой и контрольной средах при посеве клинического материала
Выявленные штаммы при испытаниях
Питательная среда
(железо-глюкозо-лактозный агар с мочевиной)
Контрольная среда Клиглера-ГРМ
Количество положительных находок:
Питательные среды Эйкмана с лактозой и глюкозой, флюорогенный селективный бульон и железо-глюкозо-лактозный агар с мочевиной успешно прошли апробацию при микробиологических исследованиях материала от больных, при вспышке бактериальной инфекции в г.Абакане в 2008 г.
Образцы испражнений из ДДУ г.Абакана (при вспышке менингококковой инфекции) были доставлены в ФГУН ГНЦ ПМБ для выявления наличия патогенных энтеробактерий.
Первичный материал был посеян для накопления и выделения на среды Эйкмана с лактозой и глюкозой, ФСБ, агар Эндо, Сорбитол E.coli 0157:Н7 агар, иерсиниозную среду. Инкубацию проводили при температуре 37 °С в течение 18 ч. В результате полученных исследований на питательных средах, в том числе и на средах Эйкмана с глюкозой и лактозой, железо-глюкозо-лактозный агар с мочевиной и на флюорогенном селективном бульоне, было подтверждено наличие колиформных бактерий E.coli во всех образцах, кроме одного образца, что указывает на высокую степень дисбактериоза кишечника.
Представители семейства Enterobacteriacea e (энтеробактерии) играют важнейшую роль в патологии человека, вызывая инфекционные процессы различной тяжести. Идет интенсивный процесс детализации таксономического положения отдельных родов и видов, выявление и описание новых. Поэтому, вполне естественно, что и бактериологам, и клиницистам приходится следить за новой информацией. Многие редкие виды не включены в базы данных наиболее распространенных коммерческих тест-систем, что затрудняет идентификацию этих микроорганизмов. Облегчает ситуацию тот факт, что использование бактериологического метода с применением набора питательных сред остается «золотым стандартом» обнаружения, выделения и идентификации микроорганизмов с типированием их родовой и видовой принадлежности.
Наиболее широко известным и распространенным способом решения данной проблемы является применение сред для первичной дифференциации.
Целью использования таких сред является накопление чистой культуры и одновременная дифференциация, основанная на регистрации некоторых биохимических свойств бактерий, что позволяет упростить процедуру дальнейшей идентификации за счет сужения круга подозреваемых микроорганизмов.
Основным результатом диссертационной работы явилась разработка и внедрение в производство новых и усовершенствованных диагностических препаратов для оценки санитарно-эпидемического состояния объектов внешней среды, клинического материала и пищевых продуктов на наличие колиформных микроорганизмов. С этой целью разработаны сухие, стандартные, высокочувствительные, пригодные к использованию как в лабораторных, так и в полевых условиях диагностические питательные среды для первичной идентификации микроорганизмов: среды Эйкмана с лактозой и глюкозой, среда Кесслера-ГРМ, SDS-бульон, железо-глюкозо-лактозный агар с мочевиной, флюорогенный селективный бульон (ФСБ).
За период с 01.01.07. по 31.10.09. в ФГУН ГНЦ ПМБ произведено SDS-бульона – 7800 кг, среды Кесслера-ГРМ – 8000 кг, железо-глюкозо-лактозного агара с мочевиной – 6000 кг.
Предложена современная методология контроля водоисточников с использованием стерилизованных ?-облучением сред Эйкмана в одноразовой индивидуальной упаковке при применении в стационарных и передвижных лабораториях.
В отличие от препаратов сравнения, разработанные среды Эйкмана с глюкозой и лактозой содержат индикатор бромтимоловый синий, что дает возможность более точно интерпретировать результаты анализа.
Применение железо-глюкозо-лактозного агара с мочевиной позволяет дифференцировать микроорганизмы по способности продуцировать сероводород, расщеплять мочевину и утилизировать глюкозу.
Для экспресс индикации и сокращения времени исследования по выявлению колиформных бактерий разработан флюорогенный селективный бульон (ФСБ), принцип действия которого основан на способности E.coli расщеплять флюорогенный субстрат, благодаря наличию ?-клюкуронидазы, с визуальным определением продуктов реакции.
Таким образом, внедрение в производство вышеуказанных питательных сред, разработка методических рекомендаций по их применению, способствует эффективному обнаружению и дифференциации колиформных микроорганизмов в исследуемых материалах.
1. Разработаны составы отечественных сухих питательных сред промышленного производства с использованием панкреатических гидролизатов рыбной муки, пептона ферментативного в качестве белковых основ. В результате определения сроков годности питательных сред Эйкмана с лактозой и глюкозой, среды Кесслера-ГРМ, SDS-бульона, железо-глюкозо-лактозного агара с мочевиной методом ускоренного хранения доказано, что расчетные сроки могут служить нормативом годности для этих питательных сред.
2. Обосновано использование железо-глюкозо-лактозного агара с мочевиной для проведения первичной идентификации по отношению к углеводам и мочевине представителей родов Yersinia и Vibrio.
3. На основе разработанного панкреатического гидролизата желатина создана новая, высокочувствительная, флюорогенная питательная среда (ФСБ), позволяющая значительно сократить время исследования.
4. Отработана технология изготовления сред Эйкмана в одноразовой индивидуальной упаковке, простерилизованных ?-облучением для исследований проб воды. В отличие от коммерческих сред, разработанные среды Эйкмана с глюкозой и лактозой содержат индикатор бромтимоловый синий, что дает возможность более точно интерпретировать результаты анализа.
5. Показана возможность использования приборов типа «Бак Трак» для определения эффективности накопительных сред (на примере сред Эйкмана).
6. По результатам исследования были разработаны, согласованы и утверждены ТУ, промышленные регламенты, инструкции по применению, а также зарегистрированы в установленном порядке и разрешены к применению питательные среды Эйкмана с лактозой (глюкозой), Кесслера-ГРМ, SDS-бульона.
7. В результате проведенных испытаний разработанных питательных сред в бактериологических лабораториях доказана их высокая эффективность. Произведенные с момента внедрения, разработанные питательные среды позволили качественно провести в баклабораториях различного уровня около восьми миллионов бактериологических исследований по обнаружению БГКП.
По теме диссертации опубликованы следующие работы:
1. Храмов М.В. Полосенко О.В., Марчихина И.И. Булатова Р.Ф. «Разработка прописи и процесса производства сухой питательной среды с мочевиной (Агар Олькеницкого–ГРМ)» // Материалы 3-ей Международной научно-практической конференции «Актуальные вопросы разработки и производства диагностических питательных сред и тест-систем» - Махачкала 2001. - С. 30 – 31.
2. Шепелин А.П. Храмов М.В. Мартовецкий М.Н. Миронова Е.Н. Марчихина И.И. ПолосенкоО.В. «Использование унифицированной белковой основы при производстве питательных сред для диагностики ООИ» // Материалы VII Межгосударственной научно-практической конференции «Чрезвычайные ситуации международного значения в общественном здравоохранении в решениях Санкт-Петербургского саммита «Группы восьми» и санитарная охрана территорий государств-участников Содружества Независимых Государств» - Оболенск 2006. - С. 255-256.
3. Полосенко О.В. Храмов М.В. «Разработка опытно-промышленной технологии производства сред Эйкмана» // Материалы ІХ Съезда Всероссийского научно - практического общества эпидемиологов, микробиологов и паразитологов.-М. 2007. - Том 3 - С. 76.
4. Храмов М.В. Полосенко О.В. Марчихина И.И. Мартовецкий М.Н. «Метод ускоренного обнаружения и выделения Е. coli и колиформных бактерий из объектов внешней среды в условиях сложной эпидобстановки» // Материалы 9 Межгосударственной научно-практической конференции " Современные технологии в реализации глобальной стратегии борьбы с инфекционными болезнями на территории государств-участников СНГ". - Волгоград 2008. - С. 125 - 126.
5. Шолохова Л.П. Марчихина И.И. Бизяева Г.В. Приймак Н.П. Полосенко О.В.. Мартовецкий М.Н. Храмов М.В. «Адаптация методов выделения энтеробактерий в соответствии с международными стандартами» // Труды конференции «Теоретические основы эпидемиологии. Современные эпидемиологические и профилактические аспекты инфекционных и массовых неинфекционных заболеваний» - С-П. 2008. - №2 (22), прил. (часть 1), - С.223.
6. Полосенко О.В. Ажермачева Н.И. Марчихина И.И. Мартовецкий М.Н. Храмов М.В. «Определение специфической активности сухих сред Эйкмана, простерилизованных радиационным методом»// Материалы Х съезда гигиенистов и санитарных врачей. - М. 2007.- Книга ІІ - С. 785 - 786.
7. Полосенко О.В. Храмов М.В. Шолохова Л.П. Ажермачева Н.И. Мартовецкий М.Н. Марчихина И.И. Мицевич Е.В. Мицевич И.П. Борзенков В.Н. «Совершенствование бактериологической диагностики кишечных инфекций» // Материалы Всероссийской научно-практической конференции «Вакцинология 2008. Совершенствование иммунобиологических средств профилактики, диагностики и лечения инфекционных болезней» - М. 2008.- С. 99.
8. Полосенко О.В. Марчихина И.И. Шолохова Л.П. Мартовецкий М.Н. Храмов М.В. «Разработка и использование новой питательной среды для выявления и идентификации санитарно-показательных микроорганизмов» // Журн. Микробиол. Эпидемиол. Иммунобиол. - М. 2008. - №6 - С. 70-72.
9. Храмов М.В. Полосенко О.В. Марчихина И.И. Мартовецкий М.Н. «Питательная среда для определения общих колиформных бактерий и Е. coli в исследуемых образцах». Приоритет по заявке на патент (рег.№ 2008125457/13 (030956)) на
№ 12-05/838.
По итогам диссертационной работы разработаны методические рекомендации «Обнаружение колиформных бактерий E.coli при санитарно – микробиологическом анализе питьевой воды с использованием питательной среды Эйкмана с лактозой.
Разработаны, утверждены и зарегистрированы технические условия:
1. ТУ 9398-089-78095326-2008 «Питательная среда для обнаружения E.coli и колиформных бактерий по признаку ферментации лактозы сухая (среда Эйкмана с лактозой)»;
2. ТУ 9398-089-78095326-2008 «Питательная среда для обнаружения E.coli и колиформных бактерий по признаку ферментации глюкозы сухая (среда Эйкмана с глюкозой)»;
3. ТУ 9398-031-78095326-2007(взамен ФСП 42-0084019200) «Питательная среда для обнаружения бактерий группы кишечной палочки сухая («Среда Кесслера-ГРМ»);
4. ТУ 9398-033-78095326-2007 (взамен ФСП 42-0084019400) «Питательная среда для выделения и идентификации энтеробактерий сухая («SDS-бульон»)».
Разработаны и утверждены регламенты производства:
1. Питательная среда для обнаружения бактерий группы кишечной палочки (среда Кесслера-ГРМ)» ПР № 78095326-23-2006;
2. Питательная среда для выделения и идентификации энтеробактерий сухая (SDS-бульона) ПР № 78095326-46-2006;
3. Питательная среда для контроля микробной загрязненности (лактозный бульон – среда для предварительного обогащения бактерий семейства Enterobacteriaceae ) «Питательная среда № 11 ГРМ» ПР № 78095326-3-2006;
Получены регистрационные удостоверения на наборы реагентов для бактериологических исследований:
1. Регистрационное удостоверение на набор реагентов для бактериологических исследований «Питательная среда для обнаружения бактерий группы кишечной палочки сухая (среда Кесслера-ГРМ) № ФСР 2007/00971 приказ Росздравнадзора от 22 октября 2007 года № 3321-Пр/07;
2. Регистрационное удостоверение на набор реагентов для бактериологических исследований «Питательная среда для выделения и идентификации энтеробактерий сухая (SDS-бульон)» № ФСР 2007/00969 приказ Росздравнадзора от 22 октября 2007 года № 3319-Пр/07;
3. Регистрационное удостоверение на набор реагентов для бактериологических исследований «Питательная среда для обнаружения E. coli и колиформных бактерий по признаку ферментации глюкозы сухая (среда Эйкмана с глюкозой)»
№ ФСР 2008/03655 от 2 декабря 2008 года № 9588-Пр/08;
4. Регистрационное удостоверение на набор реагентов для бактериологических исследований «Питательная среда для обнаружения E. coli и колиформных бактерий по признаку ферментации лактозы сухая (среда Эйкмана с лактозой)»
№ ФСР 2008/03656 от 2 декабря 2008 года № 9591-Пр/08.
5 микробных тел в материале.
3) Для лечения назначить антибиотики с учетом результата антибиотикограммы.
Задача №20 . Больной обратился к врачу с жалобами на боли в кисти, увеличение подмышечных лимфоузлов. При осмотре обнаружен панариций дистальной фалангиIIпальца левой руки.
1) Назовите предполагаемых возбудителей данного заболевания.
2) Какой материал для исследования нужно взять, какой метод диагностики применить?
3) Какие препараты нужно назначить?
1) Панариций вызывается возбудителями гнойно-воспалительных заболеваний, ведущим из которых является S.aureus.
2) Необходимо взять стерильным тампоном для исследования гнойное отделяемое и провести бактериологическое исследование, сделать посев на чашки с кровяным и желточно-солевым агаром, определить лецитиназную, гемолитическую, каталазную, плазмокоагулирующую активность, способность разлагать глюкозу и маннит в анаэробных условиях, антибиотикограмму.
3) Для лечения назначить антибиотики с учетом результата антибиотикограммы.
Задача №21 . В детском отделении родильного дома выявлены случаи гнойничковых поражений кожи у новорожденных.
1) Среди кого нужно искать источник инфекции?
2) Какие методы обследования применить?
3) Как установить идентичность культур стафилококка, выделенных из разных источников?
1) Источник необходимо искать среди персонала родильного дома.
2) См. ответ задачи № 19 п. 2.
3) Для установления идентичности культур стафилококка, выделенных из разных источников, необходимо провести фаготипирование и определение антибиотикоустойчивости.
Задача №22 . У больного, ослабленного ранее перенесенными заболеваниями, возникла вялотекущая форма фурункулеза.
1) Какова возможная причина этого заболевания?
2) Как установить идентичность культур стафилококка, выделенных из разных источников?
1) Причиной фурункулеза может быть S.aureus.
2) См. ответ задачи №19 п. 2.
3) См. ответ задачи №21 п. 3.
Задача №23 . У больного после плановой операции из отделяемого послеоперационной раны микроскопически выявлена грамотрицательная палочка, на МПА – ползучий рост, культура издает гнилостный запах.
1) О каком возбудителе нужно думать?
2) По каким свойствам идентифицировать?
3) Какие лечебные препараты применять?
1) Предполагаемый возбудитель принадлежит роду Proteus .
2) Необходимо провести бактериологическое исследование. Идентификацию возбудителя провести по биохимическим свойствам, антигенной структуре.
3) Для лечения назначить антибиотики с учетом антибиотикограммы.
Задача №24 . В микробиологическую лабораторию направлен гной зеленого цвета. При бактериологическом исследовании в нем обнаружены небольшие грамотрицательные подвижные палочки.
1) Назвать предполагаемого возбудителя.
2) Какой метод диагностики применить для решения вопроса о виде возбудителя?
3) На какие среды сеять?
4) По каким свойствам идентифицировать культуру?
5) Какие препараты следует назначить для лечения?
1) Предполагаемый возбудитель: Pseudomonasaeruginosa .
2) Необходимо провести бактериологическое исследование гноя, сделать посев на ЦПХ-агар, обратить внимание на колонии слизистой консистенции, образование водорастворимого пигмента сине-зеленого цвета. При идентификации культуры обратить внимание на положительный оксидазный и каталазный тесты, культура должна давать рост при 42 0 С и не расти при 5 0 С.
3) Для лечения назначить антибиотики с учетом антибиотикограммы.
Задача №25 . У раненого с симптомами газовой гангрены взят на анализ материал из раневого отделяемого. На основании микроскопического исследования дан положительный предварительный ответ.
1) Какие морфологические формы бактерий могут быть обнаружены при данном исследовании?
2) Какими методами следует продолжить исследование?
3) Какие препараты должен назначить врач для лечения?
1) При микроскопическом исследовании могут быть обнаружены грамположительные палочки рода Clostridium. УClostridiumperfringens может быть капсула.
2) Необходимо провести экспресс-метод диагностики – газожидкостную хроматографию. Провести бактериологическое исследование, обратить внимание на бурное газообразование на среде Китта-Тароцци, быстрое почернение и газообразование на железосульфитной среде Вильсона-Блера, газообразование в среде с молоком (по Тукаеву).
3) Для лечения следует назначить поливалентную противогангренозную антитоксическую сыворотку, антибиотики.
Задача №26 . Пострадавший в транспортной катастрофе был доставлен в стационар с обширными ранами, загрязненными почвой.
1) Какие бактерии могли быть занесены в рану с почвой?
2) Какие меры специфической профилактики следует провести в этом случае?
2) Для специфической профилактики столбняка вводят столбнячный анатоксин, для лечения – противостолбнячную сыворотку и при подозрении на газовую гангрену – противогангренозную поливалентную антитоксическую сыворотку.
Задача №27 . Рабочий во время земляных работ получил травму с поражением наружных покровов. Через 3 дня во время перевязки у него появились симптомы, подозрительные на газовую гангрену.
1) Каким экспресс-методом можно проверить предварительный диагноз?
2) Какие препараты следует назначить для лечения?
1) Необходимо провести метод газожидкостной хроматографии.
2) Противогангренозную поливалентную антитоксическую сыворотку, антибиотики.
Задача №28 . При поступлении в хирургическое отделение новой партии кетгута образцы его были направлены для исследования в бактериологическую лабораторию.
1) С какой целью был направлен кетгут в лабораторию?
2) Какие исследования нужно провести, чтобы оценить пригодность кетгута к употреблению?
1) Кетгут может быть инфицирован C.tetani .
2) Необходимо сделать посев кетгута на среду Китта-Тароцци и фильтрат среды ввести двум группам белых мышей. Одной – только фильтрат материала, и мыши погибают при специфическом симптомокомплексе «хвост трубой» – ригидный несгибаемый хвост – восходящий столбняк; другой группе мышей ввести фильтрат материала и противостолбнячную антитоксическую сыворотку – животные выживают, т.к. происходит реакция нейтрализации экзотоксина антитоксином.
Задача №29 . В одной группе детсада зарегистрирована вспышка скарлатины.
1) Как лабораторным путем доказать, что у детей скарлатина?
2) Какие методы проводятся для профилактики скарлатины?
1) Необходимо провести бактериологическое исследование: сделать посев слизи из зева на чашки с кровяным агаром, где обратить внимание на рост бета-гемолитических стрептококков, из колоний сделать мазки и, при обнаружении грамположительных цепочек кокков, поставить каталазный тест, который у стрептококков должен быть отрицательным, далее пересеять колонии на сывороточный бульон, где стрептококки дают придонный рост, затем определить серогруппу путем постановки реакции преципитации в геле, следующий этап – определяют серотип путем постановки латекс-агглютинации с М-антисыворотками.
2) Общие меры профилактики сводятся к раннему выявлению больных, соблюдению сроков изоляции (до 10 дней), мер наблюдения за контактными.
Задача №30 . Больной обратился к врачу с жалобами на боли в горле, которые беспокоят его периодически на протяжении нескольких последних лет. Врач обнаружил в зеве признаки хронического воспаления.
1) Какие бактерии могли явиться причиной этого заболевания?
2) Как их можно выделить и идентифицировать?
3) Какие лечебные препараты нужно назначить больному?
1) Streptococcuspyogenes .
2) См. ответ задачи №29 п.1.
3) Антибиотики с учетом антибиотикограммы.
Задача №31 .Больной с первичной атакой ревматизма госпитализирован для обследования с целью выявления первичного очага стрептококковой инфекции организма.
1) Какой материал нужно подвергнуть исследованию и каким методом?
2) Каким путем можно оценить степень специфического противострептококкового иммунитета?
1) Необходимо исследовать слизь из зева для выявления S.pyogenes (основного возбудителя бактериальной ангины и этиологического фактора ревматизма). Требуется провести его идентификацию бактериологическим методом.
2) Необходимо выявить в сыворотке больного АТ к факторам агрессии и инвазии S.pyogenes. анти-стрептолизин-О, антистрептокиназу, антистрептогиалуронидазу. Титр АТ должен превышать 1/512.
Задача №32. При бактериологическом исследовании мазков из мокроты больного с клиническим диагнозом пневмонии обнаружены грамположительные кокки.
1) Можно ли утверждать, что это возбудитель или необходимо провести дополнительные исследования?
2) Какой метод нужно применить для окончательного решения вопроса о пневмококковой этиологии пневмонии, по каким признакам необходимо идентифицировать культуру?
3) Какие препараты назначить для лечения, если возбудитель пневмококк?
1) Необходимы дополнительные исследования для идентификации выявленных грамположительных кокков.
2) Из грамположительных кокков в качестве возбудителя пневмонии наиболее вероятен S.pneumoniae (пневмококк) или золотистый стафилококк. Необходимо провести посев мокроты на кровяной агар для выделения стрептококков или желточно-солевой агар (ЖСА) для выделения стафилококка. На ЖСА растет только стафилококк.
В случае роста на кровяном агаре необходимо оценить характер гемолиза (пневмококк дает альфа-гемолиз) и продолжить выделение чистой культуры на сахарном бульоне. В дальнейшем для дифференциации с другими стрептококками необходимо провести оптохиновый тест, оценить рост в присутствии желчи (пневмококк не растет), поставить реакцию набухания капсул по Нейсфельду.
3) В случае доказанной пневмококковой этиологии пневмонии препаратом выбора является бензилпенициллин.
Задача №33 . В отделение поступил пациент 28 лет с явлениями интоксикации (температура 39,0 0 С, тахикардия, озноб, слабость), кашель с гнойной мокротой, в легких с двух сторон в нижних долях влажные мелкопузырчатые хрипы. Из анамнеза: болен в течение недели, состояние постепенно ухудшается.
В анализе крови выявлен лейкоцитоз до 10*10 9 /л, сдвиг лейкоцитарной формулы влево. Рентгенография грудной клетки: двусторонняя нижнедолевая пневмония, абсцесс нижней доли правого легкого.
После пункции полости абсцесса удалено 15 мл гнойного содержимого. При микроскопии гноя в большом количестве обнаружены капсульные грамотрицательные палочки.
1) Какой микроорганизм является наиболее вероятным возбудителем пнемонии и абсцесса?
2) Уточнить микробную этиологию пневмонии, назначить лечение.
1) Наиболее вероятным возбудителем болезни является K.pneumoniae .
2) Для подтверждения клебсиеллезной этиологии пневмонии необходимо провести бактериологическое исследование мокроты. С этой целью проводят посев материала на среду с индикатором и лактозой. Клебсиеллы пневмонии лактозоположительны, обладают каталазной и уреазной активностью. Антигенные свойства выделенной культуры определяют в реакции агглютинации.
При назначении лечения препаратами выбора являются антибиотики широкого спектра действия: аминогликозиды, бета-лактамы, азитромицин. После определения чувствительности выделенной культуры к антибиотикам следует провести коррекцию лечения.
Задача №34 . У больного после операции на органах брюшной полости появились симптомы разлитого перитонита.
1) Какие бактерии могли вызвать данное заболевание?
2) Какие исследования нужно провести для их выделения и идентификации?
3) Какие химиотерапевтические препараты следует использовать для лечения больного?
1) Наиболее вероятными этиологическими агентами являются условно-патогенные бактерии, находящиеся в желудочно-кишечном тракте: бактероиды, кишечная палочка и др.
2) Бактериологический с использованием анаэробной техники.
3) До получения данных бактериологического исследования назначается монотерапия (карбапенемы, например меропенем), или комбинированная терапия: аминогликозиды, метронидазол, цефалоспорины; или другие препараты с антианаэробной активностью.
Задача №35 . У пожилого пациента на фоне рецидивирующего фурункулеза наблюдается резкий подъем температуры до 38,6 0 С, озноб, тахикардия 100 ударов в минуту, лейкоцитоз 12*10 9 /л, сдвиг лейкоцитарной формулы влево. Бактериологическое исследование крови не проводилось.
1) Поставить предварительный диагноз,
2) Продолжить лабораторное обследование больного, назначить антибиотикотерапию.
1) Предварительный диагноз – сепсис. Наиболее вероятна стафилококковая этиология заболевания.
2) Следует провести забор крови (5-10 мл) и ее посев на жидкую питательную среду (в объеме до 50-100 мл) до проведения антибиотикотерапии для бактериологического исследования. Необходимо идентифицировать культуру и определить антибиотикоустойчивость выделенного штамма.
Лечение: оксациллин по схеме, возможна комбинация с аминогликозидами, карбапенемами (меропенем или имепенем).
Задача №36 . В период летних сельскохозяйственных работ несколько человек заболели. Предполагаемый диагноз лептоспироз.
1) Какой материал необходимо исследовать
2) Какие методы применить?
1) Кровь, мочу, сыворотку.
2) Методы – микроскопический, бактериологический, серологический.
Исследуют кровь на наличие возбудителя до пятого дня заболевания, мочу – на 2-3 неделе. Материал микроскопируют в фазово-контрастном или темнопольном микроскопах после приготовления препарата «висячая» или «раздавленная капля». Выявляют типичную морфологию и подвижность.
В бактериологическом методе проводят посев 5-10 мл крови и мочи в жидкие сывороточные среды, культивируют при 28 0 С. Через 5-7 дней микроскопируют среду в «темном» поле. Идентификацию возбудителя осуществляют в реакции агглютинации и лизиса, РИФ, реакции иммобилизации лептоспир антисывороткой или используют генодиагностику (ПЦР)
В серологическом методе исследуют антитела, начиная со 2-3 недели. Ставят РПГА, РСК или реакцию микроагглютинации-лизиса. Можно использовать ИФА, непрямую РИФ. Диагностический титр равен 1:400. Сыворотку исследуют в динамике, т.к. титр антител быстро нарастает.
Задача №37 . Больной обследуется на лептоспироз. Микроскопия препаратов от больного не дала положительного эффекта.
1) Можно ли отрицать лептоспироз?
2) Какой метод диагностики еще применить?
3) По каким свойствам идентифицировать культуру?
1) Лептоспироз отрицать нельзя, т.к. количество лептоспир в материале может оказаться ниже порога обнаружения методом бактериоскопии.
2-3) Необходимо провести бактериологический метод исследования: провести посев 5-10 мл крови и мочи в жидкие сывороточные среды. Через 5-7 дней микроскопировать среду в "темном" поле. Идентификацию возбудителя осуществляют в реакции агглютинации и лизиса, РИФ, реакции иммобилизации лептоспир антисывороткой. Используют биологический метод: морским свинкам внутрибрюшинно вводят 4-5 мл исследуемого материала от больного в первые дни заболевания. Через 3-4 суток исследуют экссудат брюшной полости на наличие лептоспир в "темном поле". Гибель морских свинок наступает через 8-14 дней. В трупном материале выявляют лептоспиры путем микроскопии мазков-отпечатков из внутренних органов, окрашенных методом серебрения.
Задача №38 . У больного длительное время (более месяца) субфебрильная температура, увеличение лимфатических узлов, боли в суставах, общая слабость. Работает в ветлечебнице.
1) О каком заболевании нужно думать?
2) Какой материал взять на исследование?
3) Какие методы диагностики применить?
1) Можно предположить, что у больного бруцеллез.
2) Необходимо исследовать сыворотку для обнаружения антител к возбудителю.
3) Используют серологический метод исследования. Первоначально ставят ориентировочную реакцию агглютинации по Хеддльсону на стекле с концентрированной сывороткой больного в разных количествах с единым бруцеллезным диагностикумом. Для подтверждения диагноза ставят развернутую реакцию агглютинации Райта. Диагностический титр реакции составляет 1:200. С этой же целью можно использовать РСК, РПГА, ИФА. В ранних сроках выявляют IgМ, в поздних IgG.
Проводят кожно-аллергическую пробу Бюрне с бруцеллином (протеиновый фильтрат культуры бруцелл) для выявления ПЧЗТ.
Задача №39 .У больного подозрение на сибирскую язву. Кожная форма.
1) Какой материал подлежит исследованию?
2) Перечислить методы диагностики сибирской язвы.
3) Какие свойства характерны для данного возбудителя?
1) Отделяемое из первичного очага (сибиреязвенного карбункула).
2) Бактериоскопический метод, бактериологический метод, биологическая проба, выявление антигена в материале с помощью МИФ, ИФА, реакция Асколи для обнаружения антигена в в экстрактах из тканей трупного материала, кожи, шерсти.
3) Крупные неподвижные грамположительные палочки, располагаются цепочками, окруженными общей капсулой. Образуют споры, которые располагаются центрально.
На плотных средах растут в виде крупных шероховатых R-форм колоний. Под микроскопом колонии напоминают «львиную гриву» или «голову медузы». На средах с пенициллином образуют протопласты – шары в виде цепочки – феномен "жемчужного ожерелья", выявляемый при микроскопии.
Дают гемолиз на кровяном агаре, разжижают желатин в виде елочки, к возбудителю чувствительны лабораторные животные (мыши, морские свинки, кролики).
Антигенные свойства возбудителя определяют в серологических реакциях.
Задача №40 . К врачу обратился больной, по специальности – скорняк, с жалобами на лихорадку и общее недомогание. При осмотре на коже в области запястья обнаружен карбункул.
1) Какие микроорганизмы могут вызвать подобное заболевание?
2) Какие микробиологические исследования должны быть проведены для постановки окончательного диагноза и определения факторов передачи?
3) Какие иммунологические препараты необходимо назначить для лечения больных и профилактики контактных?
1) Предварительный диагноз: «Сибирская язва, кожная форма». Возбудитель: Bacillus anthracis .
2) Бактериоскопический метод, бактериологический метод, биологическая проба, определение антигена в материале с помощью МИФ, ИФА, реакции Асколи.
3) Противосибиреязвенный иммуноглобулин, который применяется и для экстренной профилактики контактных, высокие дозы антибиотиков, лучше фторхинолоны (ципрофлоксацин).
Задача №41 . В лабораторию поступил материал (шерсть животного) для определения зараженности возбудителем сибирской язвы.
1) Какие реакции следует использовать с этой целью?
1) Следует поставить реакцию термопреципитации Асколи с сибиреязвенной преципитирующей сывороткой. Для этого из шерсти получить экстракт, прогреть, чтобы получить термостабильный антиген. Реакцию поставить по типу кольцепреципитации. При низкой концентрации антигена в материале необходимо использовать иммуноферментный анализ для его выявления.
Задача №42 . Больной обратился к врачу с жалобами на лихорадку, головные и мышечные боли. Из анамнеза выяснилось, что он работал на животноводческой ферме и употреблял в пищу не кипяченое молоко, брынзу, творог и другие молочные продукты.
1) Какие бактерии могли явиться возбудителями этого заболевания?
2) Какие микробиологические исследования должны быть проведены для диагностики этого заболевания?
1) Предполагаемые возбудители – B.melitensis иB.abortus .
2) Бактериологический метод используется редко.
Используют серологический метод исследования. Ставят ориентировочную реакцию агглютинации Хеддльсона и развернутую реакцию агглютинации Райта. Диагностический титр реакции составляет 1:200.
Проводят кожно-аллергическую пробу Бюрне с бруцеллином (протеиновый фильтрат культуры бруцелл) для выявления гиперчувствительности замедленного типа.
Задача №43 . У промыслового охотника через неделю после его возвращения с охоты на ондатру внезапно поднялась температура до 39 0 С, появились резкие головные боли и боли в мышцах, а также припухлость подмышечных лимфатических узлов (бубон).
1) Какие микроорганизмы могли вызвать подобное заболевание?
2) Какие микробиологические исследования должны быть проведены для диагностики данного заболевания?
3) Какие препараты необходимо назначить для профилактики этого заболевания?
1) Предполагаемый возбудитель – Francisella tularensis .
2) Начиная со второй недели заболевания ставят реакцию агглютинации или РПГА. Диагностический титр реакции – 1:100-1:200.
Проводят кожно-аллергическую пробу с аллергеном тулярином (взвесь возбудителя, убитого нагреванием при температуре 70 0 С, вводят 0,1 мл – 100 млн микробных тел). Реакция положительна с 3-4 дня заболевания.
Для выявления антигена в исследуемом материале используют РИФ, ИФА, реакцию преципитации.
Редко используют биобактериологический метод.
3) Специфическую профилактику проводят живой бруцеллезной вакциной в эндемических районах лицам из групп риска.
Задача №44 . Больной поступил в стационар с подозрением на возвратный тиф.
1) Какой материал нужно исследовать для подтверждения диагноза?
2) Какие методы применять?
2) Микроскопия мазков толстой капли крови, взятой на высоте лихорадки, окраска по Романовскому-Гимзе; серологические методы, биологическая проба на морской свинке (животное не заболевает).
Задача №45 . К врачу обратился больной. По специальности ветеринарный врач. Заболел внезапно. Температура 39-40 0 C, озноб, сильная головная боль, бессонница, слабость.
1) О каком заболевании нужно думать?
2) Какой материал нужно взять на исследование?
3) Какие методы применять?
4) Какова профилактика этого заболевания?
1) Предполагаемый диагноз – Ку-лихорадка.
3) Серологический метод (РСК, ИФА, РА), аллергическая проба, биологический метод (заражение морской свинки).
4) Профилактику проводят живой вакциной в областях с высокой заболеваемостью или проводят вакцинацию групп риска по специальностям (например, ветеринарам).
Задача №46 . В стационар поступил больной с высокой температурой, сильной головной болью. На коже розеолезно-петехиальная сыпь. При осмотре выявлен педикулез.
1) О каком заболевании нужно думать?
2) Какой материал исследовать?
3) Какой метод диагностики применить?
4) Какие неспецифические профилактические мероприятия должны провести работники противоэпидемической службы по месту жительства больного?
3) Серологический метод: РА, РСК, РПГА, ИФА.
4) Осмотр всех контактных на педикулез и дезинсекция в очаге.
Задача №47 . Больной поступил в стационар. Возраст 60 лет. Беспокоит головная боль, резкая слабость, высокая температура. Болен 8 дней. Лечение дома было безрезультатным. Из анамнеза выяснено, что больной в прошлом перенес сыпной тиф.
1) О каком заболевании нужно думать?
2) Как подтвердить предположение?
1) Болезнь Брилла-Цинссера.
2) Постановка серологических реакций (РПГА, ИФА); при этом определяются только IgG-антитела и отсутствуютIgM-антитела.
Задача №48 . Больной обратился к врачу с симптомами острого гнойного уретрита, появившегося через 3 дня после полового акта.
1) Какие микроорганизмы могли вызвать это заболевание?
2) Как доказать этиологию заболевания?
2) Микроскопический метод (обнаруживается незавершенный фагоцитоз диплококков при окраске метиленовым синим), бактериологический метод.
Задача №49 . При микроскопии мазка, приготовленного из мочи больного с подозрением на туберкулез почек, были обнаружены кислотоустойчивые палочки.
1) Можно ли на основании этого исследования подтвердить или исключить диагноз туберкулеза?
2) Какая возможна диагностическая ошибка?
3) Какие другие методы необходимо использовать для установления окончательного диагноза?
2) Есть нормальные кислотоустойчивые представители микрофлоры мочевыводящих путей.
3) Основной способ диагностики – бактериологический – посев на специальные среды, например – Финна, Левенштейна-Йенсена, и дальнейшая идентификация выделенной культуры.
Задача №50. При обследовании больного с вялотекущим воспалительным процессом в легких было высказано предположение о туберкулезе. При микроскопии мокроты после окраски по Циль-Нильсену выявлены кисло-устойчивые палочки. На среде Финна на 3 неделе появились ярко-оранжевые блестящие колонии.
1) Можно ли на основании этих исследований поставить диагноз туберкулеза?
2) О каком заболевании можно думать еще?
3) Как доказать, чем болен больной?
1) Нельзя, т.к. культуральные свойства выделенных бактерий не соответствуют микобактериям туберкулеза.
2) Можно думать о микобактериозе, возбудителем которого являются атипичные кислотоустойчивые бактерии, т.к. ярко-оранжевые блестящие колонии характерны для этой группы микобактерий.
3) У выделенной чистой культуры необходимо дополнительно обнаружить следующие свойства:
рост на средах с салицилатами;
наличие термостабильной каталазы;
отсутствие корд фактора;
рост при температуре 22-45 0 С.
Задача №51. Больной Б. 35 лет, жалуется на потливость, слабость, быструю утомляемость, повышение температуры до 37,2-37,5 о в течение последнего месяца, периодический кашель. При рентгенологическом обследовании обнаружена очаговая тень в области верхней доли правого легкого, увеличение бронхиальных лимфоузлов.
1) Поставить предварительный диагноз.
2) Разработать план микробиологического обследования и лечения больного.
1) Предварительный диагноз: очаговый туберкулез верхней доли правого легкого.
2) План микробиологического обследования:
1. Микроскопия мокроты по Цилю-Нильсену.
2. При отрицательном результате – микроскопия мокроты с использованием методов гомогенизации и флотации.
3. Посев мокроты на селективные среды Левенштейна-Йенсена или Финна, оценка роста колоний в течение 1-1,5 месяцев. Идентификация выделенной культуры по наличию корд-фактора, ниациновому тесту, тесту на термолабильную каталазу.
4. При отрицательном результате – проведение ПЦР для обнаружения ДНК микобактерий туберкулеза в мокроте.
Лечение: при подтверждении туберкулезной этиологии процесса – назначение курса противотуберкулезной полихимиотерапии 4-5 препаратами (тубазид, рифампицин, пиразинамид, стрептомицин и др.)
Задача №52 . В одном из классов средней школы зарегистрированы заболевания дифтерией.
1) Как проверить наличие иммунитета к дифтерии у контактных школьников?
2) Как установить источник инфекции?
3) Какие препараты применяют для специфической профилактики дифтерии?
1) Поставить РПГА с эритроцитарным диагностикумом. Титр антител при наличии иммунитета должен быть не менее 1:20.
2) Выявить бактерионосителей токсигенных штаммов бактериологическим методом с последующим определением эпидмаркеров (серовары, биовары, фаговары, корициновары).
3) Для специфической профилактики применить вакцины АКДС, АДС-М, АД.
Задача №53 . Больной поступил в стационар с предположительным диагнозом дифтерии зева.
1) Какой материал подлежит исследованию?
2) Какие экспресс-методы диагностики необходимо применить для решения вопроса о диагнозе?
3) Какой метод специфической терапии применить при подтверждении диагноза?
1) Слизь из зева, пленки фибрина.
2) Провести РПГА с антительным эритроцитарным антитоксическим диагностикумом или ИФА для обнаружения в фильтрате материала дифтерийного экзотоксина.
3) Для нейтрализации токсина немедленно назначить противодифтерийную антитоксическую сыворотку.
Задача №54 . При серологическом исследовании сыворотки крови больного ребенка с кашлем и насморком были обнаружены антитела к бактериям коклюша.
1) Можно ли на этом основании поставить диагноз «коклюш»?
2) Какие необходимо провести дополнительные исследования для подтверждения или отклонения этого диагноза?
1) Нельзя, т.к. антитела в сыворотке могли присутствовать после вакцинации.
2) Для подтверждения диагноза необходимо провести бактериологическое исследование с целью выделения возбудителя. Посев лучше сделать методом «кашлевых пластин» на среду КУА с последующей идентификацией возбудителя.
Задача №55 .У больного ребенка в мазке из зева были обнаружены бактерии, напоминающие дифтерийные палочки.
1) Можно ли на основании этих данных поставить диагноз «дифтерия»?
2) Какие необходимо провести дополнительные исследования для проверки диагноза?
3) Какие препараты следует назначить для лечения больного?
1) Нельзя, т.к. микроскопический метод является ориентировочным. Ребенок мог быть носителем нетоксигенного штамма дифтерийной палочки.
2) Необходимо провести бактериологическое исследование. У выделенной чистой культуры обязательно определить наличие токсина. Для этого можно использовать реакцию преципитации в агаре.
3) Для лечения необходимо экстренно назначить антитоксическую противодифтерийную сыворотку с целью нейтрализации токсина.
Задача №56. Больной А. 27 лет, жалуется на слабость, быструю утомляемость, повышение температуры до 37,2-37,3 о в течение последних нескольких месяцев. При объективном обследовании обнаружено увеличение большинства групп лимфоузлов, включая подключичные, локтевые, подколенные. В иммунограмме обнаружено снижение иммунорегуляторного индекса до 1,4-1,6.
1) Разработать план дальнейшего лабораторного обследования больного.
1) У больного предполагается ВИЧ-инфекция.
Для подтверждения или исключения диагноза ВИЧ-инфекции необходимо исследовать сыворотку больного на антитела к ВИЧ в иммуноферментном анализе. При положительном результате повторно исследовать сыворотку в ИФА с использованием другой тест-системы. При повторном положительном анализе ИФА направить сыворотку для проведения иммуноблот-анализа. При отрицательном результате блотинга диагноз ВИЧ исключается. При положительном результате подтверждается окончательно.
Задача №57 . В стационар поступил больной с подозрением на токсическую форму гриппа.
1) Какие методы диагностики необходимо применить?
2) Как провести индикацию и идентификацию вируса гриппа?
1) Необходимо применить 2 метода:
- ускоренный – метод иммунной флюоресценции для выявления вируса в мазках-отпечатках слизи из носа;
- вирусологический – для выделения вируса путем заражения куриного эмбриона в аллантоисную полость.
2) Для индикации вируса гриппа применить реакцию гемагглютинации, для идентификации – РТГА с противогриппозными сыворотками к разным типам вируса гриппа.